의료기기 허가도우미
의료기기 허가도우미란?
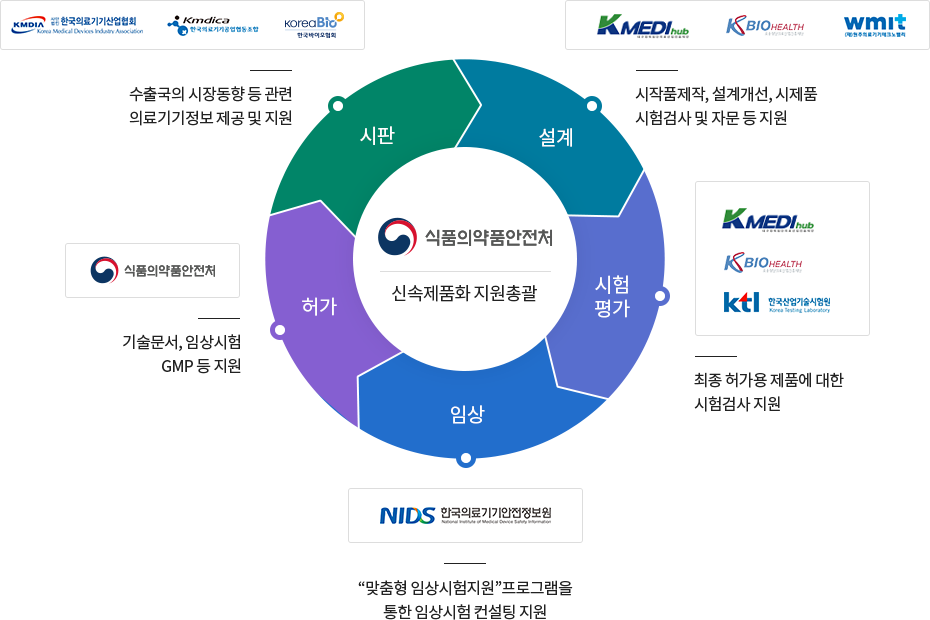
식품의약품안전처를 중심으로 다기관 협력을 통하여 제품개발 초기부터 허가 과정에서 요구되는 분야별·맞춤형·선제적 지원으로 허가 소요기간 단축과 비용절감 등의 효과를 높여, 신속제품화를 지원하는 제도입니다.
- 다기관 :
- 대구경북첨단의료산업진흥재단(K-MEDIhub)
- 오송첨단의료산업진흥재단(KBIO)
- 원주의료기기테크노밸리(WMIT)
- 한국산업기술시험원(KTL)
- 한국의료기기안전정보원(NIDS)
- 한국의료기기산업협회(KMDIA)
- 한국의료기기공업협동조합(KMDICA)
- 한국바이오협회(KOREABIO)
목적
기술의 빠른 변화와 첨단 융복합 기술의 발달에 따라 개발되는 신개발의료기기, 첨단의료기기 등에 대하여 ‘의료기기 허가도우미’로 지정하고, 식품의약품안전처 소속 직원으로 하여금 제품 개발 초기부터 허가 과정에서 요구되는 기술적 정보 및 행정적 절차 등에 대한 선제적 지원으로 허가 소요기간 단축과 비용절감 등의 효과를 높여, 신속제품화를 지원하고자 합니다.
의료기기 허가도우미 지정대상은?
의료기기 허가도우미 지정 대상은 지정신청 현재 개발 중인 제품을 대상으로 다음 각 호의 어느 하나에 해당하여야 합니다. 또한, 국내 의료기기 산업의 기여도, 사회·경제적 파급효과 등을 함께 고려하여 지정합니다.
- 신개발의료기기
- 이미 허가를 받거나 신고한 품목류 또는 품목과 작용원리, 성능 또는 사용목적 등이 본질적으로 같지 아니한 의료기기
- 첨단의료기기
- 융·복합의료기기를 포함하여 바이오기술, 정보기술, 나노기술, 로봇기술, 의료기술 등 혁신적 과학기술을 기반으로 한 새로운 의료기기
- 새로운 제품 또는 개량제품으로 임상시험에 관한 자료 제출 대상 의료기기
- 새로운 제품 : 이미 허가를 받은 의료기기와 사용목적, 작용원리 또는 원재료(의료용품에 한한다) 등이 동등하지 아니한 의료기기
- 개량 제품 : 이미 허가를 받은 의료기기와 사용목적, 작용원리 또는 원재료(의료용품에 한한다)는 동등하나 성능, 시험규격, 사용방법 등이 동등하지 아니한 의료기기
- 기타 식품의약품안전평가원장이 필요하다고 인정하는 의료기기
예 : 범부처 신속제품화 지원대상 의료기기, 신종 감염병의 진단·검사·치료·경감·처치 또는 예방할 목적의 의료기기 등
의료기기 허가도우미로 지정되면?
식약처를 중심으로 다기관과 협력하여 제품 개발 초기부터 판매까지 전주기에서 요구되는 분야별, 상황별 등에 따라 맞춤형 지원을 합니다.
- 식품의약품안전처
- 가이드라인 및 기준규격(시험기준 및 시험방법) 등 정보제공
- 기술문서 등 심사의뢰서 작성, 의료기기의 안전성 및 성능시험 설정에 대한 자문
- 제품 특성상 전문가 자문 필요시 외래전문가 지원
- 제조품질관리기준적합성(GMP) 신청서 작성 및 의료기기품질관리와 관련된 사항 자문
- 임상시험계획서 작성 및 필요 구비서류, 임상GMP, 임상시험평가 등에 대한 자문
- 진행단계별 지정업소에 대한 모니터링
- 이 외에 의료기기 허가도우미 지정업소에서 필요로 하는 사항에 대한 지원
- 협력지원기관
의료기기 허가도우미 신청
- 의료기기 허가도우미 신청 시 제출해야 하는 서류는 다음과 같습니다.
- 의료기기 허가도우미 신청 시 제출 방법은 다음과 같습니다.
- 우편 신청 시 : (우) 28166 충청북도 청주시 흥덕구 오송읍 오송생명3로 187 오송보건의료행정타운 연구심사B동 첨단의료기기과
- FAX 신청 시 : 043-719-3900
- 전자우편(Email) 신청 시 : htmd.mfds@korea.kr
의료기기 허가도우미 지정 절차
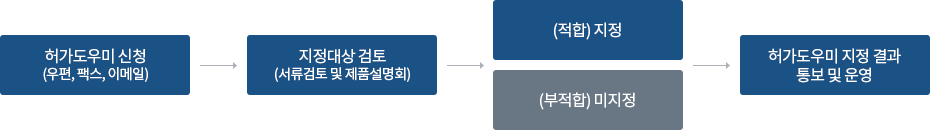
제품설명회 개최일은 신청업체와 사전 조율을 통하여 결정하며 참석대상자에게 통보
제품설명회 검토 결과를 10일 이내 회신
다기관 협력을 통한 허가도우미 소개
- 기관별 협력지원 분야
- 대구경북첨단의료산업진흥재단 - IT제품 설계·시제품제작·제품평가 자문 ☞ 홈페이지 이동
- 오송첨단의료산업진흥재단 - BT제품 설계·시제품제작·제품평가 자문 ☞ 홈페이지 이동
대구·경북 및 오송첨단의료산업진흥재단의 경우 업체와의 공동연구개발 가능
- 원주의료기기테크노밸리 - 전자의료기기 설계·시제품 제작(외형 디자인 포함)·제품평가·시장정보·마케팅 자문 ☞ 홈페이지 이동
- 한국산업기술시험원 - 시험평가·최신규격적용 자문 ☞ 홈페이지 이동
- 한국의료기기안전정보원 - 임상시험계획 사전 상담·임상시험모니터링·임상통계(통계분석,데이터관리, 증례기록서 개발 등) 자문 ☞ 홈페이지 이동
- 한국의료기기산업협회 - 인허가·공정거래·건강보험 등 산업교육, 광고심의·국내/외 전시 등 마케팅 자문 ☞ 홈페이지 이동
- 한국의료기기공업협동조합 - 보험수가 사전검토·국내/외 마케팅 자문, 국내/외 허가(인증) 관련 상담 및 교육 ☞ 홈페이지 이동
- 한국바이오협회 - 체외진단의료기기 및 시약의 해외진출 자문 ☞ 홈페이지 이동
- 다기관 협력을 통한 허가도우미 세부 지원 절차

다기관 협력을 통한 허가도우미 신청서 작성 시 요청부분을 자세히 작성하셔야 정확한 지원이 이루어집니다.









